![[Paper] WIT Transactions on Ecology](https://i0.wp.com/ecotoxilab.com/wp-content/uploads/2019/07/riotiber.png?resize=360%2C345&ssl=1)
![[Paper] WIT Transactions on Ecology](https://i0.wp.com/ecotoxilab.com/wp-content/uploads/2019/07/riotiber.png?resize=360%2C345&ssl=1)
Entradas recientes
La Innovación en nuestra empresa se nutre de la participación en proyectos nacionales y europeos, la colaboración con la comunidad científica y la aplicación de resultados al desarrollo de productos comercializables
![[Paper] WIT Transactions on Ecology](https://i0.wp.com/ecotoxilab.com/wp-content/uploads/2019/07/riotiber.png?resize=360%2C345&ssl=1)
14 \14\Europe/Madrid noviembre, 2017
Paper publicado en WIT Transactions on Ecology en el que participa NATURAL BIOTEC: con “NEW MOLECULAR TOOLS: APPLICATION OF THE AQUA PHYLOCHIP AND CONCOMITANT FISH PROBES TO STUDY FRESHWATER PATHOGENS FROM SAMPLES TAKEN ALONG THE TIBER RIVER, ITALY”. NTBC ha...La Innovación en nuestra empresa se nutre de la participación en proyectos nacionales y europeos, la colaboración con la comunidad científica y la aplicación de resultados al desarrollo de productos comercializables
Determinación de los efectos tóxicos de muestras de suelo y sedimentos en el crecimiento, fertilidad y reproducción de Caenorhabditis elegans (Nematodo)
El método se aplica a residuos, compost y enmiendas de suelo, sedimentos contaminados de agua dulce (salinidad máxima, 5 0/00), suelo, lixiviados, y extractos acuosos obtenidos de sedimentos, suelos y desechos contaminados.


Diseño del bioensayo
Los nematodos constituyen el grupo de metazoos más abundante y rico en especies que encontramos en suelos y sedimentos. Desempeñan un papel importante en los ciclos alimenticios bentónicos y del suelo. Los nematodos son organismos endobentónicos que se encuentran en varios niveles tróficos debido a que evolucionaron adoptando diferentes tipos de alimentación (bacterívoros, algívoros, omnívoros, depredadores).
El organismo de prueba C. elegans (Maupas, N2 var. Bristol) es un nematodo bacterívoro que se encuentra principalmente en los suelos, aunque se observa en sedimentos acuáticos de sistemas polisaprobianos de agua dulce. C. elegans es un organismo bien estudiado y muy fácil de cultivar. El ensayo está diseñado para medir la respuesta de este nematodo a sustancias disueltas y ligadas a partículas.
En el ensayo, los organismos juveniles de C. elegans se exponen a la muestra ambiental durante 96 h, período de tiempo en el cual los organismos de los controles pueden completar un ciclo de vida. El efecto tóxico de una muestra ambiental ocurre si la inhibición del crecimiento, fertilidad o reproducción de C. elegans, en comparación con un control (control acuoso, control de sedimento o suelo), excede un cierto valor por encima del umbral. La toxicidad se calcula en función de la intensidad del efecto, como porcentaje de inhibición.
Test en plantas terrestres: Germinación de semillas y crecimiento de las plántulas
Test de plantas terrestres: Prueba de vigor vegetativo
Estos bioensayos están diseñados para detectar los efectos tóxicos de las sustancias sobre las plantas. Se pueden utilizar para evaluar tanto la contaminación de los suelos como la adición al suelo de sustratos o enmiendas orgánicas resultantes de la valorización de diferentes residuos. También se emplean para las pruebas de productos químicos generales y productos de protección de cultivos (también conocidos como- productos de protección de plantas o pesticidas).

Realizamos análisis de muestras de:

El bioensayo de toxicidad con semillas de plantas terrestres es una prueba estática de toxicidad aguda en la que se pueden evaluar los efectos fitotóxicos de la exposición a compuestos puros o de mezclas complejas, en el proceso de germinación y en el desarrollo de las plántulas durante los primeros días de crecimiento.
Las concentraciones del bioensayo generalmente se determinan en una prueba previa de detección del rango de toxicidad. Las plantas se evalúan semanalmente para determinar los efectos de fiotoxicidad en comparación con las plantas del ensayo control. Las plantas se analizan a los 14-21 días, después de la aparición del 50% de las plántulas en ensayo control. Se miden y registran el numero de plántulas y otros parámetros; peso fresco, longitud de la radícula, longitud del epicotilo).
Indicador: Toxicidad aguda (concentración-respuesta para la inhibición de la germinación). Cálculo de la CL (50) Determinación estadística de NOEC y la concentración de efecto observado más baja (LOEC). Se determinarán los efectos patógenos que presentan las plántulas.
OECD 227: Test de plantas terrestres: Prueba de vigor vegetativo
En este bioensayo se evalúan los efectos sobre el vigor vegetativo de las plantas terrestres después de la exposición a productos fitotóxicos puros o de mezclas complejas, así como biocidas y productos de protección de cultivos. En este bioensayo la aplicación se realiza sobre las hojas y las plántulas crecida que tengan al menos 2 ó hojas verdaderas.
La sustancia de prueba se rocía sobre la superficie de la planta y las hojas a la velocidad adecuada y en las diferentes concentraciones ensayadas. Después de la aplicación, las plantas se evalúan frente a las plantas de control no tratadas para determinar los efectos sobre el vigor y el crecimiento en diversos intervalos de tiempo de 21 a 28 días desde el tratamiento. Este estudio incluye la medición de la biomasa de las plantas sobrevivientes (peso de brotes secos o frescos, altura de los brotes), efectos perjudiciales visibles en diferentes partes de la planta, fitotoxicidad visual y mortalidad (diariamente durante el estudio).
Indicador: Se utilizan análisis estadísticos apropiados para obtener una concentración efectiva. ECx o una tasa de aplicación efectiva ERx para los parámetros más sensibles de interés. Además, la concentración de efecto no observado (NOEC) y la concentración de efecto observado más baja (LOEC).
Test de inhibición del crecimiento de Algas de agua dulce y Cianobacterias
El propósito de esta prueba es determinar los efectos de una sustancia en el crecimiento de microalgas de agua dulce y/o cianobacterias. Los organismos de ensayo crecen exponencialmente expuestos a la sustancia de ensayo en cultivos con varias concentraciones de la sustancia durante un período de 72 horas normalmente. A pesar de la duración relativamente breve de la prueba, se pueden evaluar los efectos en varias generaciones de estos microorganismos.
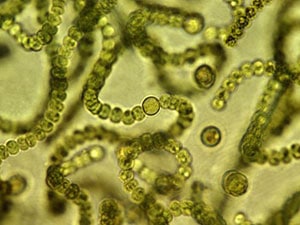
Realizamos análisis de muestras de:

Diseño del bioensayo
Se evalúa la reducción del crecimiento en una serie de cultivos de algas (replicas) expuestas a diversas concentraciones de una sustancia de prueba. Se determina la reducción del crecimiento en función de la concentración de exposición comparándola con el crecimiento promedio de las réplicas de los cultivos de control no expuestos.
Para la expresión completa de la respuesta del sistema a los efectos tóxicos (sensibilidad óptima), a los cultivos se les permite un crecimiento exponencial sin restricciones, bajo condiciones de nutrientes suficientes y luz continua durante un período de tiempo suficiente para medir la reducción de la tasa de crecimiento específica.
La inhibición del crecimiento se cuantifica realizando mediciones de la biomasa de algas generada en función del tiempo. La biomasa de algas se define como el peso seco por volumen, (por ej.; solución de ensayo mg de algas/litro). Como el peso seco es difícil de medir y, por lo tanto, se utilizan otros parámetros. Entre estos parámetros, los recuentos celulares son los más utilizados. Otros parámetros que pueden ser utilizados son; el volumen celular, la fluorescencia, la densidad óptica, etc. Se debe conocer el factor de conversión entre el parámetro empleado y la biomasa.
BIBLIOGRAFÍA: OECD/OCDE 201 GUIDELINES FOR THE TESTING OF CHEMICALS Freshwater Alga and Cyanobacteria, Growth Inhibition Test (Adopted: 23 March 2006 Annex 5 corrected: 28 July 2011)
(MICROTOX®)
Calidad del agua. Determinación del efecto inhibidor de muestras de agua sobre la luminiscencia de Vibrio fischeri (ensayo de bacterias luminiscentes)
Se determina la inhibición de la emisión de luz en los cultivos de Vibrio fischeri mediante un ensayo con varias diluciones. Se emplea para determinar la toxicidad de aguas naturales y residuales. Es aplicable tanto a muestras sólidas (sedimentos, suelos, compost y enmiendas orgánicas) como a sus extractos acuosos.
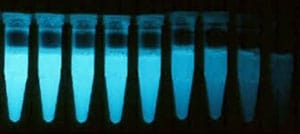
Realizamos análisis de muestras de:

El sistema Microtox® es un bioensayo que examina la toxicidad aguda de muestras medioambientales y compuestos puros basándose en la reducción de la bioluminiscencia natural de la bacteria marina Vibrio fischeri en presencia de agentes contaminantes. La toxicidad se expresa como la concentración de agente que produce la reducción del 50% de la luminiscencia inicial (EC50).
Diseño del bioensayo
Se mide la luminiscencia después de un tiempo de contacto de 15 minutos o 30 minutos y opcionalmente de 5 minutos, teniendo en cuenta un factor de corrección (fkt), que es una medida de la intensidad del control durante el tiempo de exposición. El efecto inhibitorio de la muestra de agua se puede determinar como EC50 por medio de una serie de diluciones. Las medidas especificadas en ISO 11348-3, se llevan a cabo utilizando preparaciones bacterianas liofilizadas.
Vibrio fischeri es una bacteria que se encuentra a menudo en el órgano emisor de luz de los animales marinos, como el calamar y los peces. Se utiliza como un sistema modelo para estudiar las relaciones simbióticas entre las bacterias y los animales. V. fischeri coloniza el órgano productor de luz en ciertos calamares y peces y lo ayuda a desarrollarse, sirviéndole a cambio como fuente de luz, que le ayuda a alimentarse. Los calamares hawaianos permanecen enterrados en la arena durante el día, y por la noche nadan a través del agua en busca de alimento con la ayuda de un órgano sensor de luz en su parte inferior que está compuesto por las placas bioluminiscentes de V. fischeri y un reflector de la luz.
BIBLIOGRAFÍA: ISO 11348 Water quality – Determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (Luminescent bacteria test)
Test de inmovilización aguda en Daphnia sp.
Test de la reproducción en Daphnia Magna
Estos bioensayos están diseñados para detectar los efectos tóxicos de las sustancias sobre los organismos acuáticos. Se pueden utilizar para evaluar tanto la toxicidad de una sustancia o compuesto químico conocidos, así como la toxicidad de efluentes, sustratos o cualquier otra muestra cuya composición y efectos tóxicos son desconocidos.
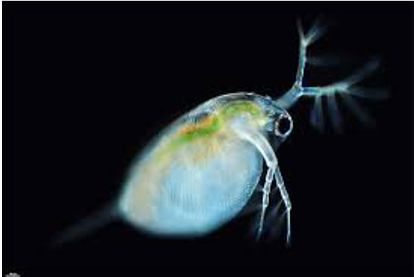
Realizamos análisis de muestras de:

[202] Test de inmovilización aguda en Daphnia sp.
En este ensayo se exponen dafnias jóvenes de menos de 24 horas de edad a un rango de concentraciones de la sustancia o muestra (al menos cinco concentraciones) durante un período de 48 horas. A las 24 y 48 horas se observa la inmovilización y se compara con los valores de control. Con los resultados obtenidos se calcula la CE50 a las 48h. Opcionalmente puede determinarse la CE50 a las 24 h. Se deben usar al menos 20 dafnias, preferiblemente divididos en cuatro grupos de cinco animales cada uno, para cada concentración de prueba y para los controles. Se emplea al menos 2 ml de solución de prueba para cada animal (es decir, un volumen de 10 ml para cinco dafnidos por recipiente de prueba).
El informe del estudio debe incluir la observación de dafnidos inmovilizados a las 24 y 48 horas después del comienzo de la prueba, y las medidas de oxígeno disuelto, pH, concentración de la sustancia de prueba, al principio y al final de la prueba. También se puede incluir la concentración máxima sin efecto (NOEC) y la concentración mínima que resulta en una inmovilidad significativa (P> = 0.05) (LOEC).
[211] Test de toxicidad reproducción en lombriz de tierra (Eisenia foetida)
Bioensayos realizados para evaluar los efectos crónicos de los compuestos químicos y contaminantes sobre la Daphnia sp.
En este ensayo se evalúa el efecto de los productos químicos o muestras a analizar, sobre la tasa de reproducción de Daphnia magna. Se emplean diferentes concentraciones conforme los resultados del estudio del ensayo de inmovilización aguda. La duración de este ensayo es de 21 días. En el informe se indican el número de crías producidas y la supervivencia de adultos y formas juveniles. El estudio se inicia con juveniles que son hembras y comienzan a producir crías vivas por partenogénesis después de aproximadamente 7 días.
Se compara la producción de crías en las diferentes concentraciones respecto de los controles, y se determina la concentración de efecto observada más baja (LOEC) y la concentración sin efecto (NOEC) además de la CE50. También se pueden registrar otros datos como la proporción de sexos y otras anomalías observadas; desarrollo anormal de formas juveniles en la bolsa de cría (ej: huevos blancos), desprendimiento de los huevos no eclosionados, huevos eifpiales, y las diferencias en el tamaño de los adultos al final de la prueba.
BIBLIOGRAFÍA
Demanda biológica de oxígeno o demanda bioquímica de oxígeno (DBO)
La demanda biológica de oxígeno o demanda bioquímica de oxígeno (DBO) es un parámetro que mide la cantidad de oxígeno (O2) consumido al degradar la materia orgánica de una muestra líquida.

Realizamos análisis de muestras de:

Es la materia susceptible de ser consumida u oxidada por medios biológicos que contiene una muestra líquida, disuelta o en suspensión. Se utiliza para medir propiamente el grado de contaminación; normalmente se mide transcurridos cinco días de reacción (DBO5) y se expresa en miligramos de oxígeno diatómico por litro (mg O2/l).
Diseño del bioensayo
El método de ensayo se basa en medir el oxígeno consumido por una población microbiana (con los procesos fotosintéticos inhibidos) en condiciones que favorecen el desarrollo de los microorganismos. La curva de consumo de oxígeno suele ser al principio débil y después se eleva rápidamente hasta un máximo sostenido, bajo la acción de la fase logarítmica de crecimiento de los microorganismos.
Es un método aplicable en aguas continentales (ríos, lagos o acuíferos), aguas negras, aguas pluviales o agua de cualquier otra procedencia que pueda contener una cantidad apreciable de materia orgánica. Este ensayo es muy útil para la apreciación del funcionamiento de las estaciones depuradoras.
No es aplicable, sin embargo, a las aguas potables, ya que al tener un contenido tan bajo de materia oxidable la precisión del método no sería adecuada. En este caso se utiliza el método de oxidabilidad con permanganato de potasio.
El objeto del ensayo consiste en medir la cantidad de oxígeno diatómico disuelto en un medio de incubación al comienzo y al final de un período de cinco días, durante el cual la muestra se mantiene al abrigo del aire, a 20°C y en la oscuridad, para inhibir la eventual formación de oxígeno por las algas mediante la fotosíntesis. Las condiciones de la medida, en las que el agua a estudiar está en equilibrio con una atmósfera cuya presión y concentración en oxígeno permanecen constantes, se acercan así a las condiciones reales de la auto depuración de un agua residual.
Para su determinación se dispone de métodos de dilución y métodos instrumentales que se derivan de métodos respirométricos que permiten seguir automáticamente la evolución de la DBO en el curso de oxidación de las materias orgánicas contenidas en el agua.
BIBLIOGRAFÍA: UNE-EN 1899-1:1998. Calidad del agua. Determinación de la demanda bioquímica de oxígeno después de n días (DBOn). Parte 1: Método de dilución y siembra con adición de alil tiourea.
Test de toxicidad aguda en peces
Test de toxicidad crónica en peces: Ensayo de 14 días
Mediante estos ensayos, se estudian los efectos que determinadas sustancias químicas y sustratos tienen sobre los peces de forma aguda o crónica, según se requiera.

Realizamos análisis de muestras de:

[203] Test de toxicidad aguda en peces
Estos bioensayos están diseñados para detectar los efectos tóxicos de las sustancias sobre los peces. Se pueden utilizar para evaluar tanto la toxicidad de una sustancia o compuesto químico conocidos, así como la toxicidad de efluentes, sustratos o cualquier otra muestra cuya composición y efectos tóxicos son desconocidos.
Los peces se exponen a la sustancia química de prueba durante un período de 96 horas, ya sea en condiciones estáticas, semiestáticas o de flujo continuo. Se registran la mortalidad, anormalidades corporales visibles y el comportamiento. Siempre que sea posible, se determinan las concentraciones que producen la mortalidad del 50% de los peces (LC50).
[204] Test de toxicidad crónica en peces: Ensayo de 14 días
Este ensayo se utiliza para medir los efectos letales y otros efectos observados en peces expuestos a las sustancias de prueba. Mediante este ensayo se estudia un período de observación más largo si se considera útil y apropiado cuando sea necesaria información adicional sobre los efectos tóxicos.
Los niveles de umbral de efectos letales y otros efectos observados y NOEC se determinan a intervalos durante el período de prueba, que es de al menos catorce días. Si es necesario, el período de prueba debe extenderse más de 14 días por una o dos semanas. La sustancia de prueba debe administrarse al menos a diez peces para cada concentración y control. Se pueden usar una o más especies, la elección queda a discreción del laboratorio de pruebas. Los peces son inspeccionados al menos una vez al día por mortalidad. El informe del estudio debe incluir la observación de efectos letales y otros efectos (por ejemplo, cambio en la apariencia, comportamiento de los peces), las mediciones de pH, oxígeno disuelto y temperatura al menos dos veces por semana.
BIBLIOGRAFÍA
Test de toxicidad aguda en lombriz de tierra (Eisenia foetida)
Test de reproducción en lombriz de tierra (Eisenia foetida)
Las lombrices de tierra, junto con otros organismos del suelo macrodescomponedores, desempeñan un papel importante en la biocenosis del suelo. Esto se debe a su capacidad para biotransformar la materia orgánica, degradando los residuos y contribuyendo a la fertilidad y microestructura del suelo. Por esta importante función, que se puede ver afectada por la presencia de elementos químicos tóxicos, las lombrices de tierra se utilizan como una especie de prueba estándar para investigar la toxicidad cuando es posible una contaminación del suelo.

Realizamos análisis de muestras de:

Se utiliza la lombriz de tierra Eisenia foetida perteneciente a Annelida, Oligochaeta (Michaelsen). Los organismos de prueba proceden de un cultivo de cría de laboratorio sincronizado. Se emplean adultos de mas de 2 meses de edad y de 300-600 mg de peso. Los ensayos se realizan con un suelo artificial (de acuerdo con los requisitos de la OCDE) que consiste en arena de cuarzo, turba de musgo, arcilla de caolín y carbonato cálcico. Los análisis se realizan en condiciones controladas de temperatura y régimen de luz e intensidad.
[207] Test de toxicidad aguda en lombriz de tierra (Eisenia foetida)
En este test se analizan los efectos agudos y subletales que causan la exposición de las sustancias de ensayo para la comunidad de lombrices. Este bioensayo proporciona datos de toxicidad representativos de la exposición natural de las lombrices a los productos químicos contaminantes.
Diseño del bioensayo: Inicialmente se realiza una prueba detección inicial de toxicidad (prueba de contacto en papel de filtro) utilizando cinco o más niveles de tratamiento en una serie geométrica de concentraciones y diez repeticiones (una lombriz para cada tratamiento); se mantiene en la oscuridad y durante un período de 48 horas. Posteriormente se realiza el ensayo manteniendo las lombrices de tierra un suelo artificial en al menos cinco concentraciones. Se debe usar una concentración que resulte en no mortalidad y una que resulte en mortalidad total. Se realizan cuatro réplicas para cada tratamiento con 10 individuos por réplica. La mortalidad se evalúa 7 y 14 días después de la aplicación. Como parámetros subletales se registran el peso corporal medio y las anomalías de comportamiento.
Indicador: toxicidad aguda (concentración-respuesta para la mortalidad). Cálculo de la CL (50) y si es posible determinación estadística de NOEC.
[222] Test de toxicidad reproducción en lombriz de tierra (Eisenia foetida)
En este test se analizan los efectos crónicos, sobre la reproducción y subletales que causan la exposición de las sustancias de ensayo para la comunidad de lombrices. Con este bioensayo obtenemos datos de toxicidad que nos indican los efectos de la exposición natural de las lombrices a los productos químicos contaminantes.
Diseño del bioensayo: se realizan 8 concentraciones para el diseño ECx) con cuatro réplicas cada una y los controles positivo y negativo correspondientes. Para los productos fitosanitarios, el objetivo principal de este estudio es demostrar que la concentración de efecto no observado (NOEC) del producto es 5 veces menor que la concentración ambiental pronosticada (PEC) (establecida como el umbral de aceptabilidad). En cada réplica se utilizan 10 lombrices adultos que estarán expuestas durante 4 semanas. La mortalidad y los cambios de peso se evalúan después de este tiempo. La descendencia se expone posteriormente otras 4 semanas hasta que se alcanza un período de exposición total de 8 semanas.
Indicador: Cálculo estadístico de la ECx /NOEC. Además, se registran otros efectos subletales como cambios de peso corporal y actividad de alimentación. Como el objetivo de este ensayo radica en la reproducción, el rango de concentraciones analizadas producen en su mayoría una mortalidad leve o nula.
BIBLIOGRAFÍA

Esta web utiliza cookies para que podamos ofrecerte la mejor experiencia de usuario posible. La información de las cookies se almacena en tu navegador y realiza funciones tales como reconocerte cuando vuelves a nuestra web o ayudar a nuestro equipo a comprender qué secciones de la web encuentras más interesantes y útiles.
Las cookies estrictamente necesarias tiene que activarse siempre para que podamos guardar tus preferencias de ajustes de cookies.
Si desactivas esta cookie no podremos guardar tus preferencias. Esto significa que cada vez que visites esta web tendrás que activar o desactivar las cookies de nuevo.